Процессы мышечной работы представляют собой многоуровневый комплекс физиологических и биохимических функций, жизненно важных для полноценной работы человеческого организма. Внешне подобные процессы можно наблюдать на примерах произвольных движений при ходьбе, беге, изменении мимики и т. д. Однако они охватывают гораздо больший спектр функций, в числе которых также значится работа дыхательного аппарата, органов пищеварения и выделительной системы. В каждом случае механизм мышечных сокращений подкрепляется работой миллионов клеток, в которой задействуются химические элементы и физические волокна.
Мышцы
Мышцы объединяются в группы, у которых одинаковый механизм мышечных сокращений. По этому же признаку они и разделяются на 3 вида:
- поперечно-полосатые мышцы тела;
- поперечно-полосатые мышцы предсердий и сердечных желудочков;
- гладкие мышцы органов, сосудов и кожи.
Поперечно-полосатые мышцы входят в опорно-двигательный аппарат, являясь его частью, так как помимо них сюда входят сухожилия, связки, кости. Когда реализуется механизм мышечных сокращений, выполняются следующие задачи и функции:
- тело передвигается;
- части тела перемещаются друг относительно друга;
- тело поддерживается в пространстве;
- вырабатывается тепло;
- кора активируется посредством афферентации с рецептивных мышечных полей.
Из гладких мышц состоит:
- двигательный аппарат внутренних органов, в который входят бронхиальное дерево, легкие и пищеварительная трубка;
- лимфатическая и кровеносная системы;
- система мочеполовых органов.
Особенности проведения возбуждения в нервно-мышечном синапсе
Одностороннее проведение возбуждения — только в направлении от пресинаптического окончания к постсинаптической мембране.
Суммация возбуждения соседних постсинаптических мембран.
Синаптическая задержка — замедление в проведении импульса от нейрона к мышце составляет 0,5-1 мс. Это время затрачивается на секрецию медиатора, его диффузию к постсинаптической мембране, взаимодействие с рецептором, формирование ПКП, их суммацию.
Низкая лабильность — она составляет 100-150 имп/с для сигнала, что в 5-6 раз ниже лабильности нервного волокна.
Чувствительность к действию лекарственных веществ, ядов, БАВ, выполняющих роль медиатора.
Утомляемость химических синапсов — выражается в ухудшении проводимости вплоть до блокады в синапсе при длительном функционировании синапса. Главная причина утомляемости — исчерпание запасов медиатора в пресинаптическом окончании.
Законы проведения возбуждения по нервам:
- Закон функциональной целостности нерва.
- Закон изолированного проведения возбуждения.
- Закон двустороннего проведения возбуждения.
В зависимости от скорости проведения возбуждения нервные волокна подразделяются на 3 группы: A, B, C. В группе A выделяют 4 подгруппы: альфа, бетта, гамма и сигма.
Физиологические свойства
Как и у всех позвоночных животных, в человеческом организме выделяют три самых важных свойства волокон скелетных мышц:
- сократимость — сокращение и изменение напряжения при возбуждении;
- проводимость — движение потенциала по всему волокну;
- возбудимость — реагирование на раздражитель посредством изменения мембранного потенциала и ионной проницаемости.
Мышцы возбуждаются и начинают сокращаться от нервных импульсов, идущих от центров. Но в искусственных условиях используют электростимуляцию. Мышца тогда может раздражаться напрямую (прямое раздражение) или через нерв, иннервирующий мышцу (непрямое раздражение).
Источник энергии для сокращения
Как мы уже знаем, сокращение мышц, это движение (размыкание-смыкание) поперечных мостиков, и естественно, это процесс нуждается в энергообеспечении. Однако, запас энергии в мышцах очень мал, поэтому ее необходимо постоянно откуда-то «черпать», восстанавливать.
Предлагаем ознакомиться Документы для развода через суд в 2019 году: полный список
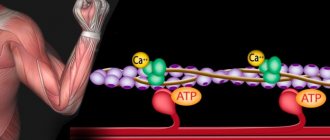
Основным и главным поставщиком энергии, благодаря которому происходит энергообеспечение организма, служит молекула АТФ, которая расщепляется, благодаря головкам миозиновых мостиков, таким образом, образуется энергия для сокращения мышц. Однако, мышечная клетка содержит в себе ограниченный запас молекул АТФ, их количество хватает всего на 8 повторений, первые 2 секунды:
- АТФ H2O = АДФ H3PO4 энергия
Проблема в ограниченном обеспечении энергии для мышечного сокращения легко решается с помощью ресинтеза или пересоздания молекул АТФ.
АТФ — как универсальный источник энергии человека
В зависимости от времени нахождения мышц под нагрузкой, а также от степени интенсивности выполнения того или иного упражнения, можно выделить следующие виды систем, которые обеспечивают энергию для мышц:
- Фосфогенная (АТФ и КрФ)
- Гликолитическая (анаэробный и аэробный гликолиз)
- Окисление (расщепляются углеводы и липиды при активном поступлении кислорода)
2 Пируват 4ATP 2GTP 2NADH 2H 4H2O → глюкоза 4ADP 2GDP 6Pi 2NAD
Каждая энергетическая система характеризуется мощностью и емкостью.
Мощность – показатель, который ограничивает интенсивность выполняемой физической работы, и характеризует максимальное количество энергии, которое выделяется в единицу времени, а также максимальное количество ресинтезируемых АТФ в единицу времени.
В свою очередь, емкость энергетических систем, ограничивает продолжительность работы мышц.
Для сокращения мышцы используется энергия гидролиза АТФ, но мышечная клетка имеет крайне эффективную систему регенерации запаса АТФ, так что в расслабленной и работающей мышце содержание АТФ примерно равно. Фермент фосфокреатинкиназа катализирует реакцию между АДФ и креатинфосфатом, продукты которой — АТФ и креатин.
Креатинфосфат содержит больше запасённой энергии, чем АТФ. Благодаря этому механизму при вспышке активности в мышечной клетке падает содержание именно креатинфосфата, а количество универсального источника энергии — АТФ — не изменяется. Механизмы регенерации запаса АТФ могут различаться в зависимости от парциального давления кислорода в окружающих тканях (см. Анаэробные организмы).
Виды сокращений
Механизм мышечных сокращений подразумевает преобразование химической энергии в механическую работу. Этот процесс можно измерить при эксперименте с лягушкой: ее икроножную мышцу нагружают небольшим весом, а затем раздражают легкими электроимпульсами. Сокращение, при котором мышца становится короче, называется изотоническим. При изометрическом сокращении укорачивания не происходит. Сухожилия не позволяют при развитии мышцей силы укорачиваться. Еще один ауксотонический механизм мышечных сокращений предполагает условия интенсивных нагрузок, когда мышца укорачивается минимальным образом, а сила развивается максимальная.
Фазы сокращения
Когда мускулатура приводится в действие раздражающим импульсом сверхпороговой силы, происходит одиночное сокращение, в котором можно выделить 3 фазы:
- Уже упомянутый выше период сокращения латентного типа, в процессе которого волокна накапливают энергию для совершения последующих действий. В это время проходят процессы электромеханического сопряжения и открываются центры связок. На данной стадии подготавливается механизм сокращения мышечного волокна, который активизируется после распространения соответствующего импульса.
- Фаза укорочения – длится 50 мс в среднем.
- Фаза расслабления – также длится примерно 50 мс.
Структура и иннервация скелетных мышц
В поперечно-полосатые скелетные мышцы входит множество волокон, находящихся в соединительной ткани и крепящихся к сухожилиям. В одних мышцах волокна расположены параллельно длинной оси, а в других они имеют косой вид, прикрепляясь к центральному тяжу сухожильному и к перистому типу.
Главная особенность волокна заключается в саркоплазме массы тонких нитей — миофибрилл. В них входят светлые и темные участки, чередующиеся друг с другом, а у соседних поперечно-полосатые волокна находятся на одном уровне — на поперечном сечении. Благодаря этому получается поперечная полосатость по всему волокну мышц.
Саркомером является комплекс из темного и двух светлых дисков, и он отграничивается Z-образными линиями. Саркомеры — это сократительный аппарат мышцы. Получается, что сократительное мышечное волокно состоит из:
- сократительного аппарата (системы миофибрилл);
- трофического аппарата с митохондриями, комплексом Гольджи и слабой эндоплазматической сетью;
- мембранного аппарата;
- опорного аппарата;
- нервного аппарата.
Мышечное волокно разделяется на 5 частей со своими структурами и функциями и является целостной частью ткани мышц.
Саркомеры и филаменты
Саркомеры представляют собой сегменты волокон, которые отделяются так называемыми Z-пластинами, содержащими бета-актинин. От каждой пластины отходят актиновые филаменты, а промежутки заполняются толстыми миозиновыми аналогами. Актиновые элементы, в свою очередь, похожи на ниточки бус, закрученных в двойную спираль. В этой структуре каждая бусинка является молекулой актина, а в участках с углублениями в спирали находятся молекулы тропонина. Каждая из этих структурных единиц формирует механизм сокращения и расслабления мышечного волокна, связываясь друг с другом. Ключевую роль в возбуждении волокон играет клеточная мембрана. В ней заключены поперечные трубочки-инвагинации, которые активизируют функцию саркоплазматического ретикулума – это и будет возбуждающий эффект для мышечной ткани.
Иннервация
Этот процесс у поперечно-полосатых мышечных волокон реализуется посредством нервных волокон, а именно аксонов мотонейронов спинного мозга и головного ствола. Один мотонейрон иннервирует несколько волокон мышц. Комплекс с мотонейроном и иннервируемыми мышечными волокнами называют нейромоторной (НМЕ), или двигательной единицей (ДЕ). Среднее число волокон, которые иннервирует один мотонейрон, характеризует величину ДЕ мышцы, а обратную величину называют плотностью иннервации. Последняя является большой в тех мышцах, где движения небольшие и «тонкие» (глаза, пальцы, язык). Малое ее значение будет, напротив, в мышцах с «грубыми» движениями (например, туловище).
Иннервация может быть одиночной и множественной. В первом случае она реализуется компактными моторными окончаниями. Обычно это характерно для крупных мотонейронов. Мышечные волокна (называющиеся в этом случае физическими, или быстрыми) генерируют ПД (потенциалы действий), которые распространяются на них.
Множественная иннервация встречается, к примеру, во внешних глазных мышцах. Здесь не генерируется потенциал действия, так как в мембране нет электровозбудимых натриевых каналов. В них распространяется деполяризация по всему волокну из синаптических окончаний. Это необходимо для того, чтобы привести в действие механизм мышечного сокращения. Процесс здесь происходит не так быстро, как в первом случае. Поэтому его называют медленным.
Мышечная система человека
Мышечная система человека позволяет координировать движения тела, держать его в равновесии, осуществлять дыхание, а также транспорт пищи и крови внутри организма, помимо всего она защищает внутренности от повреждений, а также выполняет роль преобразователя энергии химической в механическую и тепловую.
В теле человека всего три типа мышц:
- скелетные
- гладкие
- мышца сердца
Мышечная система человека (A — мышца сердца, B — скелетные мышцы, C — гладкие мышцы)
Скелетная мускулатура
Скелетная мускулатура человека, она же поперечнополосатая, крепится к костям, состоит из волокон, а они в свою очередь состоят из мышечных клеток. В каждой мышечной клетке имеется два ядра, которые отвечают за деление и восстановление. За сокращение мышцы отвечают, так называемые миофибриллы (нити), которые содержаться в мышечных клетках. Количество миофибрилл в мышечной клетке может достигать до несколько тысяч. Таким образом, мышечные клетки формируют ткань, а она в свою очередь образовывает мышцу.
Наши скелетные мышцы содержат волокна, нервные окончание и кровеносные сосуды. Сокращение мышцы происходит с помощью нервных импульсов, которые поступают от спинного мозга до мышечной ткани, то есть передача нервного импульса осуществляется по пути — головной мозг → спинной мозг → нужные нам мышцы. Теперь понятно, почему повреждение спинного мозга так опасно.
Человек регулирует интенсивность сокращения мышц с помощью силы подаваемого импульса по нервным окончаниям.
Скелетная мускулатура человека
Гладкие мышцы
Гладкая мускулатура выполняет не произвольные сокращения, состоит из веретеновидных клеток, являясь одной из самых важных составляющих мышечных полых органов, а также составной частью кровеносных и лимфатических сосудов, помогает транспортировать содержимое полых органов (транспорт пищи кишечнику), сужения зрачка, корректировка артериального давления, и другие процессы, которые происходят непроизвольно.
Все сокращения гладким мышц не вызывают утомления, регулируются вегетативной системой (автономная нервная система, которая отвечает за работу внутренних органов).
Натренировать гладкие мышцы можно, например, увеличивая выносливость, вы улучшаете работу сердечно-сосудистую системы.
Гладкие мышцы
Сердечная мышца
Сердце непрерывно сокращается в течении всей жизни, обеспечивая движение, перекачку крови, питательных веществ, других жизненно-важных веществ по сосудам к тканям организма. Выполняя роль насоса, сердце работает в режиме непрерывных, ритмичных, одиночных сокращений.
Строение волокна миокарда, напоминает структуру скелетных мышц, которые также содержат миофибриллы, состоящие из актина и миозина, включая тропонин-тропомиозиновый белковый комплекс.
Картинку сердце, где показанна устройство сердца где можно увидеть миокард
Механизм мышечного сокращения сердца, происходить все по тем же причинам, что и в поперечнополосатых мышцах, благодаря ионами Ca2+ (кальция), которые освобождаются из саркоплазматического ретикулума (мембранная органелла мышечных клеток), только в этом случае он менее упорядочен (по сравнению со скелетной мускулатурой).
Сердечная мышца и ее устройство
Структура миофибрилл
Исследования мышечного волокна сегодня проводятся на основе рентгеноструктурного анализа, электронной микроскопии, а также гистохимическими методами.
Рассчитано, что в каждую миофибриллу, диаметр которой составляет 1 мкм, входит примерно 2500 протофибрилл, то есть удлиненных полимеризованных молекул белков (актина и миозина). Актиновые протофибриллы в два раза тоньше миозиновых. В покое эти мышцы находятся так, что актиновые нити кончиками проникают в промежутки между миозиновыми протофибриллами.
Узкая светлая полоса в диске А свободна от актиновых нитей. А мембрана Z скрепляет их.
На миозиновых нитях есть поперечные выступы длиной до 20 нм, в головках которых находится порядка 150 молекул миозина. Они отходят биополярно, и каждая головка соединяет миозиновую с актиновой нитью. Когда происходит усилие актиновых центров на нитях миозина, актиновая нить приближается к центру саркомера. В конце миозиновые нити доходят до линии Z. Тогда они занимают собой весь саркомер, а актиновые находятся между ними. При этом длина диска I сокращается, а в конце он исчезает полностью, вместе с чем линия Z становится толще.
Так, по теории скользящих нитей, объясняется сокращение длины волокна мышцы. Теория, получившая название «зубчатого колеса», была разработана Хаксли и Хансоном в середине двадцатого века.
Оптимум и пессимум частоты
Амплитуды сокращений определяются частотой импульсов, которые раздражают мышечные волокна. В этой системе взаимодействия сигналов и откликов можно выделить оптимум и пессимум частоты. Первым обозначается частота, которая в момент действия будет накладываться на фазу повышенной возбудимости. В таком режиме может активизироваться механизм сокращения мышечного волокна с большой амплитудой. В свою очередь, пессимум определяет более высокую частоту, импульс которой приходится на фазу рефрактерности. Соответственно, в этом случае амплитуда уменьшается.
Механизм мышечного сокращения волокна
Главным в теории является то, что не нити (миозиновые и актиновые) укорачиваются. Длина их остается неизменной и при растяжении мышц. Но пучки тонких нитей, проскальзывая, выходят между толстыми нитями, уменьшается степень их перекрытия, таким образом происходит сокращение.
Молекулярный механизм мышечного сокращения посредством скольжения актиновых нитей заключается в следующем. Миозиновые головки соединяют протофибриллу с актиновой. При их наклонах происходит скольжение, двигающее актиновую нить к центру саркомера. За счет биполярной организации миозиновых молекул на обеих сторонах нитей создаются условия для скольжения актиновых нитей в разные стороны.
При расслаблении мышц миозиновая головка отходит от актиновых нитей. Благодаря легкому скольжению расслабленные мышцы растяжению сопротивляются гораздо меньше. Поэтому они пассивно удлиняются.
Влияние растяжения на силу сокращений: кривая растяжения в покое
рис. 2.9 Влияние предварительного растяжения на силу сокращения мышцы. Предварительное растяжение повышает напряжение мышцы. Результирующая кривая, описывающая взаимоотношения длины мышцы и силы ее сокращения при воздействии активного и пассивного растяжения, демонстрирует более высокое изометрическое напряжение, чем в покое
Важным фактором, влияющим на силу сокращений, является величина растяжения мышцы. Тяга за конец мышцы и натяжение мышечных волокон называются пассивным растяжением. Мышца обладает эластическими свойствами, однако в отличие от стальной пружины зависимость напряжения от растяжения не линейна, а образует дугообразную кривую. С увеличением растяжения повышается и напряжение мышцы, но до определенного максимума. Кривая, описывающая эти взаимоотношения, называется кривой растяжения в покое
.
Данный физиологический механизм объясняется эластическими элементами мышцы — эластичностью сарколеммы и соединительной ткани, располагающимися параллельно сократительным мышечным волокнам.
Также при растяжении изменяется и наложение друг на друга миофиламентов, однако это не оказывает влияния на кривую растяжения, т. к. в покое не образуются поперечные связи между актином и миозином. Предварительное растяжение (пассивное растяжение) суммируется с силой изометрических сокращений (активная сила сокращений).
Ионы кальция
Для лучшего понимания процесса активации волокна ионами кальция удобно рассмотреть структуру актиновой нити. Длина ее составляет порядка 1 мкм, толщина — от 5 до 7 нм. Это пара закрученных ниток, которые напоминают мономер актина. Примерно через каждые 40 нм здесь находятся сферические тропониновые молекулы, а между цепями — тропомиозиновые.
Когда ионы кальция отсутствуют, то есть миофибриллы расслабляются, длинные тропомиозиновые молекулы блокируют крепление актиновых цепей и мостиков миозина. Но при активизации ионов кальция тропомиозиновые молекулы опускаются глубже, и участки открываются.
Тогда миозиновые мостики прикрепляются к актиновым нитям, а АТФ расщепляется, и сила мышц развивается. Это становится возможным за счет воздействия кальция на тропонин. При этом молекула последнего деформируется, проталкивая тем самым тропомиозин.
Когда мышца расслаблена, в ней на 1 грамм сырого веса содержится больше 1 мкмоль кальция. Соли кальция изолированы и находятся в особых хранилищах. В противном случае мышцы бы все время сокращались.
Хранение кальция происходит следующим образом. На разных участках мембраны клетки мышцы внутри волокна имеются трубки, через которые происходит соединение со средой вне клеток. Это система поперечных трубочек. А перпендикулярно ей находится система продольных, на концах которых — пузырьки (терминальные цистерны), расположенные в непосредственной близости к мембранам поперечной системы. Вместе получается триада. Именно в пузырьках хранится кальций.
Так ПД распространяется внутрь клетки, и происходит электромеханическое сопряжение. Возбуждение проникает в волокно, переходит в продольную систему, высвобождает кальций. Таким образом осуществляется механизм сокращения мышечного волокна.
Механика мышечных сокращений[править | править код]
Источник: «Спортивная диагностика»
Автор:
профессор В.П. Губа, 2020 год
Если мышцу стимулировать коротким электрическим импульсом, спустя небольшой латентный период происходит ее сокращение. Такое сокращение называется «одиночное сокращение мышцы». Одиночное мышечное сокращение длится около 10-50 мс, причем оно достигает максимальной силы через 5-30 мс.
Каждое отдельное мышечное волокно подчиняется закону «все или ничего», т. е. при силе раздражения выше порогового уровня происходит полное сокращение с максимальной для данного волокна силой, а ступенчатое повышение силы сокращения по мере увеличения силы раздражения невозможно. Поскольку смешанная мышца состоит из множества волокон с различным уровнем чувствительности к возбуждению, сокращение всей мышцы может быть ступенчатым в зависимости от силы раздражения, при этом при сильных раздражениях происходит активация глубжележащих мышечных волокон.
Механизм скольжения филаментов[править | править код]
рис. 1. Схема образования поперечных связей — молекулярной основы сокращения саркомера
Укорочение мышцы происходит за счет укорочения образующих ее саркомеров, которые, в свою очередь, укорачиваются за счет скольжения относительно друг друга актиновых и миозиновых филаментов (а не укорочения самих белков). Теория скольжения филаментов была предложена учеными Huxley и Hanson (Huxley, 1974; рис. 1). (В 1954 г. две группы исследователей — X. Хаксли с Дж. Хэнсон и А. Хаксли с Р. Нидергерке — сформулировали теорию, объясняющую мышечное сокращение скольжением нитей. Независимо друг от друга они обнаружили, что длина диска А оставалась постоянной в расслабленном и укороченном саркомере. Это позволило предположить, что есть два набора нитей — актиновые и миозиновые, причем одни входят в промежутки между другими, и при изменении длины саркомера эти нити каким-то образом скользят друг по другу. Сейчас эта гипотеза принята почти всеми.)
Актин и миозин — два сократительных белка, которые способны вступать в химическое взаимодействие, приводящее к изменению их взаимного расположения в мышечной клетке. При этом цепочка миозина прикрепляется к актиновой нити с помощью целого ряда особых «головок», каждая из которых сидит на длинной пружинистой «шее». Когда происходит сцепление между миозиновой головкой и актиновой нитью, конформация комплекса этих двух белков изменяется, миозиновые цепочки продвигаются между актиновыми нитями и мышца в целом укорачивается (сокращается). Однако, чтобы химическая связь между головкой миозина и активной нитью образовалась, необходимо подготовить этот процесс, поскольку в спокойном (расслабленном) состоянии мышцы активные зоны белка актина заняты другим белком — тропохмиозином, который не позволяет актину вступить во взаимодействие с миозином. Именно для того, чтобы убрать тропомиозиновый «чехол» с актиновой нити, требуется быстрое выливание ионов кальция из цистерн саркоплазматического ретикулума, что происходит в результате прохождения через мембрану мышечной клетки потенциала действия. Кальций изменяет конформацию молекулы тропомиозина, в результате чего активные зоны молекулы актина открываются для присоединения головок миозина. Само это присоединение осуществляется с помощью так называемых водородных мостиков, которые очень прочно связывают две белковые молекулы — актин и миозин — и способны в таком связанном виде находиться очень долго.
Для отсоединения миозиновой головки от актина необходимо затратить энергию аденозинтрифосфа-та (АТФ), при этом миозин выступает в роли АТФазы (фермента, расщепляющего АТФ). Расщепление АТФ на аденозиндифосфат (АДФ) и неорганический фосфат (Ф) высвобождает энергию, разрушает связь между актином и миозином и возвращает головку миозина в исходное положение. В дальнейшем между актином и миозином могут снова образовываться поперечные связи.
При отсутствии АТФ актин-миозиновые связи не разрушаются. Это и является причиной трупного окоченения (rigor mortis) после смерти, т. к. останавливается выработка АТФ в организме — АТФ предотвращает мышечную ригидность.
Даже при мышечных сокращениях без видимого укорочения (изометрические сокращения, см. выше) активируется цикл формирования поперечных связей, мышца потребляет АТФ и выделяет тепло. Головка миозина многократно присоединяется на одно и то же место связывания актина, и вся система миофиламентов остается неподвижной.
Внимание
: Сократительные элементы мышц актин и миозин сами по себе не способны к укорочению. Мышечное укорочение является следствием взаимного скольжения миофиламентов относительно друг друга (механизм скольжения филаментов).
Как же образование поперечных связей (водородных мостиков) переходит в движение? Одиночный саркомер за один цикл укорачивается приблизительно на 5-10 нм, т.е. примерно на 1 % своей общей длины. За счет быстрого повторения цикла поперечных связей возможно укорочение на 0,4 мкм, или 20% своей длины. Поскольку каждая миофибрилла состоит из множества саркомеров и во всех них одновременно (но не синхронно) образуются поперечные связи, суммарно их работа приводит к видимому укорочению всей мышцы. Передача силы этого укорочения происходит через Z-линии миофибрилл, а также концы сухожилий, прикрепленных к костям, в результате чего и возникает движение в суставах, через которые мышцы реализуют перемещение в пространстве частей тела или продвижение всего тела.
Механизм АТФ
После завершения движения молекула АФТ обеспечивает энергией для разделения участвующих в реакции миозина и актина. Миозиновые головки разделяются, АТФ расщепляется до фосфата и АДФ. В конце подсоединяется новая АТФ-молекула, и цикл возобновляется. Таковым является механизм мышечного сокращения и расслабления на молекулярном уровне.
Активность поперечных мостиков будет продолжаться лишь до тех пор, пока происходит гидролиз АТФ. При блокировке фермента мостики не станут снова прикрепляться.
С наступлением смерти организма уровень АТФ в клетках падает, и мостики остаются устойчиво прикрепленными к актиновой нити. Так происходит стадия трупного окоченения.
Введение
Схема, показывающая мышцы в расслабленном (выше) и сокращённом (ниже) положениях.
Основой всех типов мышечного сокращения служит взаимодействие актина и миозина. В скелетных мышцах за сокращение отвечают миофибриллы (примерно две трети сухого веса мышц). Миофибриллы — структуры толщиной 1 — 2 мкм, состоящие из саркомеров — структур длиной около 2,5 мкм, состоящих из актиновых и миозиновых (тонких и толстых) филаментов и Z-дисков, соединённых с актиновыми филаментами.
Ресинтез АТФ
Ресинтез возможно реализовать двумя путями.
Посредством ферментативного переноса от креатинфосфата фосфатной группы на АДФ. Так как запасов в клетке креатинфосфата намного больше АТФ, ресинтез реализуется очень быстро. В то же время посредством окисления пировиноградной и молочной кислот ресинтез будет осуществляться медленно.
АТФ и КФ могут исчезнуть полностью, если ресинтез будет нарушен ядами. Тогда и кальциевый насос прекратит работу, вследствие чего мышца необратимо сократится (то есть настанет контрактура). Таким образом, нарушится механизм мышечного сокращения.
Двигательная единица
Теперь стоит отойти от углубленной структуры мышцы и рассмотреть двигательную единицу в общей конфигурации скелетной мышцы. Это будет совокупность мышечных волокон, иннервируемых отростками мотонейрона. Работа ткани мышцы независимо от характера действия будет обеспечиваться волокнами, включенными в состав одной двигательной единицы. То есть при возбуждении мотонейрона срабатывает механизм мышечных сокращений в рамках одного комплекса с иннервируемыми отростками. Такое разделение на мотонейроны позволяет целенаправленно задействовать конкретные мышцы, не возбуждая без надобности соседние двигательные единицы. По сути, вся мышечная группа одного организма делится на сегменты мотонейронов, которые могут объединяться в работе над сокращением или расслаблением, а могут действовать разнопланово или поочередно. Главное, что они независимы друг от друга и работают только с сигналами своей группы волокон.
Физиология процесса
Подытоживая вышесказанное, отметим, что сокращение волокна мышцы состоит в укорочении миофибрилл в каждом из саркомеров. Нити миозина (толстые) и актина (тонкие) связаны концами в расслабленном состоянии. Но они начинают скользящие движения друг навстречу к другу, когда реализуется механизм мышечного сокращения. Физиология (кратко) объясняет процесс, когда под влиянием миозина выделяется необходимая энергия для преобразования АТФ в АДФ. При этом активность миозина будет реализована лишь при достаточном содержании ионов кальция, накапливающихся в саркоплазматической сети.
Сопряжение возбудительных и сократительных процессов
В спокойном состоянии нити волокон не взаимодействуют друг с другом посредством скольжения, так как центры связок закрываются молекулами тропомиозина. Возбуждение может иметь место только после электромеханического сопряжения. Данный процесс также делится на несколько этапов:
- При активации нейромышечного синапса на мембране миофибриллы формируется так называемый постсинаптический потенциал, накапливающий энергию для действия.
- Возбуждающий импульс благодаря системе трубок расходится по мембране и активизирует ретикулум. Этот процесс в итоге способствует снятию барьеров с каналов мембраны, по которым выпускаются ионы, связывающиеся с тропонином.
- Белок тропонин, в свою очередь, открывает центры связок актина, после чего становится возможным механизм мышечных сокращений, но для его начала также потребуется соответствующий импульс.
- Использование открывшихся центров начнется в момент, когда к ним присоединятся головки миозина по описанной выше модели.
Полный цикл этих операций происходит в среднем за 15 мс. Период от начальной точки возбуждения волокон до полного сокращения называется латентным.
Основные белки миофибрилл
| Белок | Доля белка % | Его мол. масса, kDa | Его функция |
| Миозин | 44 | 510 | Главный компонент толстых филаментов. Образует связи с актином. Движется по актину за счёт гидролиза АТФ. |
| Актин | 22 | 42 | Главный компонент тонких филаментов. Во время сокращения мышцы по нему движется миозин. |
| Титин | 9 | 2500 | Большой гибкий белок, образующий цепь для связывания миозина с Z-диском. |
| Тропонин | 5 | 78 | Комплекс из трёх белков, регулирующий сокращение при связывании с ионами Ca2 . |
| Тропомиозин | 5 | 64 | Связанный с актиновыми филаментами стержневидный белок, блокирующий движение миозина. |
| Небулин | 3 | 600 | Длинный нерастяжимый белок, связанный с Z-диском и идущий параллельно актиновым филаментам. |
Roll and lock: поворачиваем и запираем
По гипотезе рычага, в мышечном сокращении существует только один момент генерации силы — когда поворачивается миозиновый хвост (рычаг). Однако некоторые данные рентгенографии и томографии мышц не то чтобы не согласуются с этой теорией, а свидетельствуют о том, что существует еще какой-то непонятный момент в сокращении мышцы, который гипотеза рычага не объясняет. Поэтому группа исследователей под руководством А. К. Цатуряна предложила теорию мышечного сокращения под названием «Roll and lock» — «Поворачиваем и запираем» (см.: Michael A. Ferenczi et al., 2005. The «Roll and Lock» Mechanism of Force Generation in Muscle). По этой теории, миозиновые головки садятся на актин еще до гидролиза АТФ, причем садятся не стройно и организованно, а как попало. На головке миозина есть длинный выступающий домен — «щуп», — который «нащупывает» подходящую себе (кислую и отрицательно заряженную) часть актиновой нити и прилипает к ней — как придется, под первым попавшимся углом. Однако стоит произойти гидролизу АТФ, как миозин меняет свою конформацию, головки поворачиваются под нужным углом и крепко и четко, как ключ с замком, сцепляются с актиновой нитью, а из миозинового кармана выбрасывается фосфат. И вот только после этого происходит поворот рычага. Иными словами, модель получается двухстадийной — на первом этапе головка миозина крепко и четко вцепляется в актин и при этом немного поворачивается, а на втором — поворачивается рычаг, причем сила, которая потом приведет к движению мышцы, генерируется на обоих этих этапах.
Помимо рентгеноструктурных и томографических данных, которые очень хорошо согласуются с теорией «Roll and lock», существует и несколько косвенных, но очень красивых доказательств ее правоты. Например, известно, что во время мышечного сокращения, в том случае, если мышца не меняет свою длину, всего чуть более 40% миозиновых головок сидит на актине, а остальные болтаются ни к чему не присоединенными. Однако когда сжатую мышцу насильно растягивают (например, такое бывает при беге, когда человек приземляется на напряженную мышцу), то жесткость мышцы резко увеличивается из-за того, что почти все свободные миозиновые головки резко сцепляются с актиновой нитью. Однако, судя по рентгеноструктурным данным, сцепляются они отнюдь не «намертво», как ключ с замком, а просто как попало. Объяснить это можно как раз с помощью теории «Roll and lock». Гидролиз АТФ при растяжении мышцы прекращается (оно и понятно: какой смысл тратить АТФ, если работа совершается не мышцей
, а
над мышцей
), и все миозиновые головки переходят в состояние «активного актинового поиска» — их торчащий щуп ищет актиновую нить, нащупывает на ней подходящее место и сцепляется с ним — не крепко-накрепко, не как ключ с замком, а как попало. Однако для того, чтобы увеличить жесткость мышцы (и этим защитить кости от перелома) этого оказывается достаточно.
Скольжение миозина относительно актина
Головки миозина расщепляют АТФ и за счет высвобождающейся энергии меняют конформацию, скользя по актиновым филаментам. Цикл можно разделить на 4 стадии:
- Свободная головка миозина связывается с АТФ и гидролизует его до АДФ и фосфата и остаётся связанной с ними. (Обратимый процесс — энергия, выделившаяся в результате гидролиза, запасается в изменённой конформации миозина).
- Головки слабо связываются со следующей субъединицей актина, фосфат отделяется, и это приводит к прочному связыванию головки миозина с актиновым филаментом. Эта реакция уже необратима.
- Головка претерпевает конформационное изменение, производящее подтягивание толстого филамента к Z-диску (или, что эквивалентно, свободных концов тонких филаментов друг к другу).
- Отделяется АДФ, за счёт этого головка отделяется от актинового филамента. Присоединяется новая молекула АТФ.
Далее цикл повторяется до уменьшения концентрации ионов Ca2+ или исчерпании запаса АТФ (в результате смерти клетки). Скорость скольжения миозина по актину ≈15 мкм/сек. В миозиновом филаменте много (около 500) молекул миозина и, следовательно, при сокращении цикл повторяется сотнями головок сразу, что и приводит к быстрому и сильному сокращению. Следует заметить, что миозиин ведёт себя как фермент — актин-зависимая АТФаза. Так как каждое повторение цикла связано с гидролизом АТФ, а следовательно, с положительным изменением свободной энергии, то процесс однонаправленный. Миозин движется по актину только в сторону плюс-конца.
Последовательные стадии