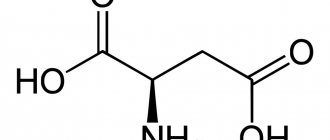
Химические вещества, содержащие структурные компоненты молекулы карбоновой кислоты и амина, называются аминокислотами. Это общее название группы органических соединений, в составе которых присутствует углеводородная цепь, карбоксильная группа (-СООН) и аминогруппа (-NH2). Их предшественниками являются карбоновые кислоты, а молекулы, у которых водород у первого углеродного атома замещен аминогруппой, называются альфа-аминокислотами.
Всего 20 аминокислот имеют ценность для ферментативных реакций биосинтеза, протекающих в организме всех живых существ. Эти вещества называются стандартными аминокислотами. Существуют также нестандартные аминокислоты, которые включены в состав некоторых специальных белковых молекул. Они не встречаются повсеместно, хотя выполняют важную функцию в живой природе. Вероятно, радикалы этих кислот модифицируются уже после биосинтеза.
Общая информация и список веществ
Известны две большие группы аминокислот, которые были выделены по причине закономерностей их нахождения в природе. В частности, существуют 20 аминокислот стандартного типа и 26 нестандартных аминокислот. Первые находят в составе белков любого живого организма, тогда как вторые являются специфическими для отдельных живых организмов.
20 аминокислот стандартных делятся на 2 типа в зависимости от способности синтезироваться в человеческом организме. Это заменимые, которые в клетках человека способны образовываться из предшественников, и незаменимые, для синтеза которых не существует ферментных систем или субстрата. Заменимые аминокислоты могут не присутствовать в пище, так как их организм может синтезировать, восполняя их количество при необходимости. Незаменимые аминокислоты не могут быть получены организмом самостоятельно, а поэтому должны поступать с пищей.
Биохимиками определены названия аминокислот из группы незаменимых. Всего их известно 8:
- метионин;
- треонин;
- изолейцин;
- лейцин;
- фенилаланин;
- триптофан;
- валин;
- лизин;
- также часто сюда относят гистидин.
Это вещества с различным строением углеводородного радикала, но обязательно с наличием карбоксильной группы и аминогруппы у альфа-С-атома.
В группе заменимых аминокислот присутствует 11 веществ:
- аланин;
- глицин;
- аргинин;
- аспарагин;
- кислота аспарагиновая;
- цистеин;
- кислота глютаминовая;
- глютамин;
- пролин;
- серин;
- тирозин.
В основном их химическое строение проще, нежели у незаменимых, поэтому их синтез дается организму легче. Большинство незаменимых аминокислот невозможно получить только из-за отсутствия субстрата, то есть молекулы-предшественника путем реакции переаминирования.
Глицин, аланин, валин
В биосинтезе белковых молекул наиболее часто используется глицин, валин и аланин, (формула каждого вещества указана ниже на рисунке). Эти аминокислоты самые простые по химической структуре. Вещество глицин и вовсе является простейшим в классе аминокислот, то есть помимо альфа-углеродного атома соединение не имеет радикалов. Однако даже простейшая по структуре молекула играет важную роль в обеспечении жизнедеятельности. В частности, из глицина синтезируется порфириновое кольцо гемоглобина, пуриновые основания. Порфировое кольцо — это белковый участок гемоглобина, призванный удерживать атомы железа в составе целостного вещества.
Глицин участвует в обеспечении жизнедеятельности головного мозга, выступая тормозным медиатором ЦНС. Это означает, что он в большей степени участвует в работе коры головного мозга — его наиболее сложно организованной ткани. Что важнее, глицин является субстратом для синтеза пуриновых оснований, нужных для образования нуклеотидов, которые кодируют наследственную информацию. Вдобавок глицин служит источником для синтеза других 20 аминокислот, тогда как сам может быть образован из серина.
У аминокислоты аланин формула немногим сложнее, чем у глицина, так как она имеет метильный радикал, замененный на один атом водорода у альфа-углеродного атома вещества. При этом аланин также остается одной из самых часто вовлекаемых в процессы биосинтеза белков молекулой. Она входит в состав любого белка в живой природе.
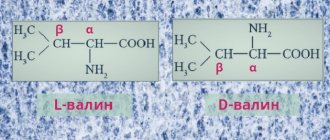
Неспособный синтезироваться в организме человека валин — аминокислота с разветвленной углеводородной цепочкой, состоящей из трех углеродных атомов. Изопропиловый радикал придает молекуле больший вес, однако из-за этого невозможно найти субстрат для биосинтеза в клетках человеческих органов. Поэтому валин должен обязательно поступать с пищей. Он присутствует преимущественно в структурных белках мышц.
Результаты исследований подтверждают, что валин необходим для функционирования центральной нервной системы. В частности, за счет его способности восстанавливать миелиновую оболочку нервных волокон он может использоваться в качестве вспомогательного средства при лечении рассеянного склероза, наркоманий, депрессий. В большом количестве содержится в мясных продуктах, рисе, сушеном горохе.
Лейцин в спорте: истинная любовь бодибилдера.Пищевая добавка ВСАА
Нужно сказать, что лейцин является главной составляющей (более 70%) популярной пищевой добавки ВСАА. Сегодня лейцин все чаще применяют в спорте. Не секрет, что особую любовь к ней испытывают бодибилдеры. Но если атлет будет принимать только лейцин, то его потребуется есть ложками, а такие объемы вредны для почек. Кроме того полноценное усвоение аминокислот происходит в присутствии витаминов группы В. Также установлено, что две другие аминокислоты с разветвленной цепью, изолейцин и валин, намного усиливают действие лейцина.
Интересно, что лейцин вместе с другими ВСАА, заставляет организм выделять серин и треонин, которые образуют фосфорилирующий поток. Такой эффект стимулирует синтез протеина, который необходим для роста мышц. Вот почему эта аминокислота так любима бодибилдерами и тяжелоатлетами. И действительно, правильно, пользуясь ее возможностями, можно ускорить рост мышечной массы. Компании, производящие пищевые добавки ВСАА, наиболее часто используют такое соотношение лейцина к изолейцину и валину: 2:1:1. Тренеры рекомендуют принимать это спортивное питание перед тренировкой и сразу после нее, чтобы использовать возможности «белково-углеводного окна». Особенного эффекта можно достичь, употребляя добавку во время самих занятий – через каждые 20 минут.
Тирозин, гистидин, триптофан
В организме тирозин способен синтезироваться из фенилаланина, хотя в большом количестве поступает с молочной пищей, преимущественно с творогом и сырами. Входит в состав казеина — животного белка, в избытке содержащемся в творожных и сырных продуктах. Ключевое значение тирозина в том, что его молекула становится субстратом синтеза катехоламинов. Это адреналин, норадреналин, дофамин — медиаторы гуморальной системы регуляции функций организма. Тирозин способен быстро проникать и через гематоэнцефалический барьер, где быстро превращается в дофамин. Молекула тирозина участвует в меланиновом синтезе, обеспечивая пигментацию кожи, волос и радужки глаза.
Аминокислота гистидин входит в состав структурных и ферментных белков организма, является субстратом синтеза гистамина. Последний регулирует желудочную секрецию, участвует в иммунных реакциях, регулирует заживление повреждений. Гистидин является незаменимой аминокислотой, и организм восполняет ее запасы только из пищи.
Триптофан так же неспособен синтезироваться организмом из-за сложности своей углеводородной цепочки. Он входит в состав белков и является субстратом синтеза серотонина. Последний является медиатором нервной системы, призванным регулировать циклы бодрствования и сна. Триптофан и тирозин — эти названия аминокислот следует помнить нейрофизиологам, так как из них синтезируются главные медиаторы лимбической системы (серотонин и дофамин), обеспечивающие наличие эмоций. При этом не существует молекулярной формы, обеспечивающей накопление незаменимых аминокислот в тканях, из-за чего они должны присутствовать в пище ежедневно. Белковая еда в количестве 70 граммов в сутки полностью обеспечивает эти потребности организма.
В каких продуктах содержится аминокислота лейцин
Поступление в организм соединения возможно только с пищей. Существенное значение имеет сбалансированное питание с включением в рацион продуктов преимущественно животного происхождения.
К основным источникам вещества относят:
- яичный порошок;
- концентрат соевого белка;
- икру;
- сыры;
- морепродукты (кальмары);
- бобовые культуры (фасоль, горох);
- рыбу (окунь, скумбрию, судак, щуку, сельдь);
- мясо (индейку, говядину, баранину, свинину нежирную);
- орехи (арахис, фундук, миндаль, кунжут, фисташки);
- семена подсолнечника;
- яйцо куриное;
- кукурузную крупу.
Рекомендуем к прочтению: Чем полезен миндаль, свойства и противопоказания
Незначительное количество органического соединения включают грибы, овощи и фрукты.
Внимание! Алкогольные напитки препятствуют усвояемости незаменимой аминокислоты.
Фенилаланин, лейцин и изолейцин
Фенилаланин примечателен тем, что из него синтезируется аминокислота тирозин при ее недостатке. Сам фенилаланин является структурным компонентом всех белков в живой природе. Это метаболический предшественник нейромедиатора фенилэтиламина, обеспечивающий ментальную концентрацию, подъем настроения и психостимуляцию. В РФ в концентрации свыше 15% оборот данного вещества запрещен. Эффект фенилэтиламина схожий с таковым у амфетамина, однако первый не отличается пагубным воздействием на организм и отличается лишь развитием психической зависимости.
Одно из главных веществ группы аминокислот — лейцин, из которого синтезируются пептидные цепи любого белка человека, включая ферменты. Соединение, применяемое в чистом виде, способно регулировать функции печени, ускорять регенерацию ее клеток, обеспечивать омоложение организма. Поэтому лейцин — аминокислота, которая выпускается в виде лекарственного препарата. Она отличается высокой эффективностью в ходе вспомогательного лечения цирроза печени, анемии, лейкоза. Лейцин — аминокислота, существенно облегчающая реабилитацию пациентов после химиотерапии.
Изолейцин, как и лейцин, не способен синтезироваться организмом самостоятельно и относится к группе незаменимых. Однако это вещество не является лекарственным средством, так как организм испытывает в нем небольшую потребность. В основном в биосинтезе участвует только один его стереоизомер (2S,3S)-2-амино-3-метилпентановая кислота.
Пролин, серин, цистеин
Вещество пролин — аминокислота с циклическим углеводородным радикалом. Ее основная ценность в наличии кетонной группы цепочки, из-за чего вещество активно используется в синтезе структурных белков. Восстановление кетона гетероцикла до гидроксильной группы с образованием гидроксипролина формирует множественные водородные связи между цепочками коллагена. В результате нити этого белка сплетаются между собой и обеспечивают прочную межмолекулярную структуру.
Пролин — аминокислота, обеспечивающая механическую прочность тканей человека и его скелета. Наиболее часто она находится в коллагене, входящем в состав костей, хряща и соединительной ткани. Как и пролин, цистеин является аминокислотой, из которой синтезируется структурный белок. Однако это не коллаген, а группа веществ альфа-кератинов. Они образуют роговой слой кожи, ногти, имеются в составе чешуек волос.
Вещество серин — аминокислота, существующая в виде оптических L и D-изомеров. Это заменимое вещество, синтезируемое из фосфоглицерата. Серин способен образовываться в ходе ферментативной реакции из глицина. Данное взаимодействие обратимое, а поэтому глицин может образовываться из серина. Основная ценность последнего в том, что из серина синтезируются ферментативные белки, точнее их активные центры. Широко серин присутствует в составе структурных белков.
Аргинин, метионин, треонин
Биохимиками определено, что избыточное потребление аргинина провоцирует развитие заболевания Альцгеймера. Однако помимо негативного значения у вещества присутствуют и жизненно-важные для размножения функции. В частности, за счет наличия гуанидиновой группы, пребывающей в клетке в катионной форме, соединение способно образовывать огромное количество водородных межмолекулярных связей. Благодаря этому аргинин в виде цвиттер-иона обретает способность связаться с фосфатными участками молекул ДНК. Результатом взаимодействия является образование множества нуклеопротеидов — упаковочной формы ДНК. Аргинин в ходе изменения рН ядерного матрикса клетки может отсоединяться от нуклеопротеида, обеспечивая раскручивание цепи ДНК и начало трансляции для биосинтеза белка.
Аминокислота метионин в своей структуре содержит атом серы, из-за чего чистое вещество в кристаллическом виде имеет неприятный тухлый запах из-за выделяемого сероводорода. В организме человека метионин выполняет регенераторную функцию, способствуя заживлению мембран печеночных клеток. Поэтому выпускается в виде аминокислотного препарата. Из метионина синтезируется и второй препарат, предназначенный для диагностики опухолей. Синтезируется он путем замещения одного углеродного атома на его изотоп С11. В таком виде он активно накапливается в опухолевых клетках, давая возможность определять размеры новообразований головного мозга.
В отличие от указанных выше аминокислот, треонин имеет меньшее значение: аминокислоты из него не синтезируются, а его содержание в тканях невелико. Основная ценность треонина — включение в состав белков. Специфических функций эта аминокислота не имеет.
Аспарагин, лизин, глутамин
Аспарагин — распространенная заменимая аминокислота, присутствующая в виде сладкого на вкус L-изомера и горького D-изомера. Из аспарагина образуются белки организма, а путем глюконеогенеза синтезируется оксалоацетат. Это вещество способно окисляться в цикле трикарбоновых кислот и давать энергию. Это означает, что помимо структурной функции аспарагин выполняет и энергетическую.
Неспособный синтезироваться в организме человека лизин — аминокислота с щелочными свойствами. Из нее в основном синтезируются иммунные белки, ферменты и гормоны. При этом лизин — аминокислота, самостоятельно проявляющая антивирусные средства против вируса герпеса. Однако вещество в качестве препарата не используется.
Аминокислота глутамин присутствует в крови в концентрациях, намного превышающих содержание прочих аминокислот. Она играет главную роль в биохимических механизмах азотистого обмена и выведения метаболитов, участвует в синтезе нуклеиновых кислот, ферментов, гормонов, способна укреплять иммунитет, хотя в качестве лекарственного препарата не используется. Но глутамин широко применяется среди спортсменов, так как помогает восстанавливаться после тренировок, удаляет метаболиты азота и бутирата из крови и мышц. Этот механизм ускорения восстановления спортсмена не считается искусственным и справедливо не признается допинговым. Более того, лабораторные способы уличения спортсменов в таком допинге отсутствуют. Глутамин также в значительном количестве присутствует в пище.
Как получить аминокислоты?
Роль АК в жизни людей имеет колоссальное значение в любой период жизнедеятельности. Для восстановления этого сложного и нужного баланса при нормальном ритме жизни достаточно употреблять продукты, богатые аминокислотами. Однако, этого недостаточно для профессиональных спортсменов, людей, стремящихся нарастить мышечную массу и для тех, чья профессия или образ жизни связаны с повышенными нагрузками экстремального характера. В таких случаях лучше воспользоваться специальными органическими комплексами с большим содержанием аминокислот.
Аспарагиновая и глутаминовая кислота
Аспарагиновая и глутаминовая аминокислоты чрезвычайно ценные для организма человека из-за своих свойств, активирующих нейромедиаторов. Они ускоряют передачу информации между нейронами, обеспечивая поддержание работоспособности структур мозга, лежащих ниже коры. В таких структурах важна надежность и постоянство, ведь эти центры регулируют дыхание и кровообращение. Поэтому в крови присутствует огромное количество аспарагинивой и глутаминовой аминокислоты. Пространственная структурная формула аминокислот указана на рисунке ниже.
Аспарагиновая кислота участвует в синтезе мочевины, устраняя аммиак из головного мозга. Она является значимым веществом для поддержания высокой скорости размножения и обновления клеток крови. Разумеется, при лейкозе этот механизм вреден, а поэтому для достижения ремиссии используются препараты ферментов, разрушающих аспарагиновую аминокислоту.
Одну четвертую часть от числа всех аминокислот в организме составляет глутаминовая кислота. Это нейромедиатор постсинаптических рецепторов, необходимый для синаптической передачи импульса между отростками нейронов. Однако для глутаминовой кислоты характерен и экстрасинаптический путь передачи информации — объемная нейротансмиссия. Такой способ лежит в основе памяти и представляет собой нейрофизиологическую загадку, ведь пока не выяснено, какие рецепторы определяют количество глутамата вне клетки и вне синапсов. Однако предполагается, что именно количество вещества вне синапса имеет важность для объемной нейротрансмиссии.
Назначение незаменимых аминокислот
Белки и НАК имеют огромное значение для правильного функционирования всех систем организма человека. Белок, который поступает извне, наиболее полноценный при его сбалансированном составе. Потребность в НАК резко возрастает при интенсивных занятиях спортом и больших рисках травм. Невозможно наращивание мышечной массы при нехватке АК в организме. Для быстрого восстановления после физических и стрессовых нагрузок, истребления жиров и поддержания отличной формы необходимо употреблять продукты, богатые НАК для правильного их баланса в сложной системе функционирования человека.
Химическая структура
Все нестандартные и 20 стандартных аминокислот имеют общий план строения. Она включает циклическую или алифатическую углеводородную цепочку с наличием радикалов или без них, аминогруппу у альфа-углеродного атома и карбоксильную группу. Углеводородная цепочка может быть любой, чтобы вещество имело реакционную способность аминокислот, важно расположение основных радикалов.
Аминогруппа и карбоксильная группа должны быть присоединены к первому углеродному атому цепочки. Согласно принятой в биохимии номенклатуре, он называется альфа-атомом. Это важно для образования пептидной группы — важнейшей химической связи, благодаря которой существуют белок. С точки зрения биологической химии, жизнью называется способ существования белковых молекул. Главное значение аминокислот — это образование пептидной связи. Общая структурная формула аминокислот представлена в статье.
Физические свойства
Несмотря на схожую структуру углеводородной цепи, аминокислоты по физическим свойствам значительно отличаются от карбоновых кислот. При комнатной температуре они являются гидрофильными кристаллическими веществами, хорошо растворяются в воде. В органическом растворителе из-за диссоциации по карбоксильной группе и отщепления протона аминокислоты растворяются плохо, образуя смеси веществ, но не истинные растворы. Многие аминокислоты имеют сладкий вкус, тогда как карбоновые кислоты — кислые.
Указанные физические свойства обусловлены наличием двух функциональных химических групп, из-за которых вещество в воде ведет себя как растворенная соль. Под действием молекул воды от карбоксильной группы отщепляется протон, акцептором которого является аминогруппа. За счет смещения электронной плотности молекулы и отсутствия свободно двигающихся протонов рН (показатель кислотности) раствор остается достаточно стабильным при добавлении кислот или щелочей с высокими константами диссоциации. Это означает, что аминокислоты способны образовывать слабые буферные системы, поддерживая гомеостаз организма.
Важно, что модуль заряда диссоциированной молекулы аминокислоты равен нулю, так как протон, отщепленный от гидроксильной группы, принимается атомом азота. Однако на азоте в растворе формируется положительный заряд, а на карбоксильной группе — отрицательный. Способность диссоциировать напрямую зависит от кислотности, а поэтому для растворов аминокислот существует изоэлектрическая точка. Это рН (показатель кислотности), при котором наибольшее количество молекул имеют нулевой заряд. В таком состоянии они неподвижны в электрическом поле и не проводят ток.
Лекция № 16. Аминокислоты. Пептиды
- Shares
Лекция № 1765
АМИНОКИСЛОТЫ. ПЕПТИДЫ
План
- Методы получения.
- Химические свойства.
- Аминокислоты, входящие в состав белков.
- Пептиды
Лекция № 16
АМИНОКИСЛОТЫ. ПЕПТИДЫ
План
- Методы получения.
- Химические свойства.
- Аминокислоты, входящие в состав белков.
- Пептиды
Аминокислоты – гетерофункциональные соединения, содержащие карбоксильную и аминогруппы. По взаимному расположению функциональных групп различают a -,b -, g — и т.д. аминокислоты. Аминокислоты, содержащие аминогруппу на конце цепи, называют w -аминокислотами.
1. Методы получения
!) Аммонолиз галогензамещенных кислот.
Метод используется для синтеза a -аминокислот из доступных a -галогензамещенных кислот.
2) Метод Штеккера- Зелинского
Включает стадии образования аминонитрила при взаимодействии альдегида с HCN и NH3 c последующим гидролизом его в аминокислоту. В качестве реагента применяют смесь NaCN и NH4Cl.
Метод применим для синтеза только a -аминокислот.
3) Восстановительное аминирование оксокислот
4) Присоединение аммиака к a ,b -непредельным карбоновым кислотам.
Метод применим для синтеза b -аминокислот.
5) Из оксимов циклических кетонов перегруппировкой Бекмана.
Метод используется для синтеза w -аминокислот.
2. Химические свойства
Аминокислоты дают реакции, характерные для карбоксильной и аминогрупп, и, кроме того, проявляют специфические свойства, которые определяются наличием двух функциональных групп и их взаимным расположением.
2.1. Кислотно-основные свойства
Аминокислоты содержат кислотный и основный центры и являются амфотерными соединениями. В кристаллическом состоянии они существуют в виде внутренних солей (биполярных ионов), которые образуются в результате внутримолекулярного переноса протона от более слабого основного центра (СОО—) к более сильному основному центру (NH2).
Ионное строение аминокислот подтверждается их физическими свойствами. Аминокислоты – нелетучие кристаллические вещества с высокими температурами плавления. Они нерастворимы в неполярных органических растворителях и растворимы в воде. Их молекулы обладают большими дипольными моментами.
Форма существования аминокислот в водных растворах зависит от рН. В кислых растворах аминокислоты присоединяют протон и существуют преимущественно в виде катионов. В щелочной среде биполярный ион отдает протон и превращается в анион.
При некотором значении рН, строго определенном для каждой аминокислоты, она существует преимущественно в виде биполярного иона. Это значение рН называют изоэлектрической точкой
(
рI).
В изоэлектрической точке аминокислота не имеет заряда и обладает наименьшей растворимостью в воде. Катионная форма аминокислоты содержит два кислотных центра (COOH и NH3+) и характеризуется двумя константами диссоциации рКа1 и рКа2. Значение рI определяется по уравнению:
2.2. Реакции по аминогруппе
Дезаминирование
Аминокислоты содержат первичную аминогруппу и подобно первичным аминам взаимодействуют с азотистой кислотой с выделением азота. При этом происходит замещение аминогруппы на гидроксильную.
RCH(NH2)COOH + HNO2 ® RCH(OH)COOH + N2 + H2O
Реакция используется для количественного определения аминокислот по объему выделившегося азота (метод Ван-Слайка).
Алкилирование и арилирование
При взаимодействии аминокислот с избытком алкилгалогенида происходит исчерпывающее алкилирование аминогруппы и образуются внутренние соли.
Аминокислоты арилируются 2,4-динитрофторбензолом (ДНФБ) в щелочной среде. Реакция протекает как нуклеофильное замещение в активированном ароматическом кольце.
Реакция используется для установления аминокислотной последовательности в пептидах.
Ацилирование
Аминокислоты взаимодействуют с ангидридами и хлорангидридами с образованием N-ацильных производных.
Реакция используется для защиты аминогруппы в синтезе пептидов. Такая защита должна легко сниматься, а амиды, как известно, гидролизуются в жестких условиях. При разработке методов синтеза пептидов были найдены защитные группы, которые легко удаляются путем гидролиза или гидрогенолиза.
Карбобензоксизащита:
трет-Бутоксикарбонильная защита (БОК-защита).
Легкость снятия защиты обусловлена устойчивостью бензил- и трет
-бутил-катионов, которые образуются в качестве интермедиатов.
2.3. Реакции по карбоксильной группе
Декарбоксилирование
При сухой перегонке в присутствии гидроксида бария аминокислоты декарбоксилируются с образованием аминов.
Этерификация
Аминокислоты взаимодействуют со спиртами в присутствии газообразного HCl как катализатора с образованием сложных эфиров.
В отличие от самих аминокислот, их сложные эфиры – легко летучие соединения и могут быть разделены путем перегонки или газожидкостной хроматографии, что используется для анализа и разделения смесей аминокислот, полученных при гидролизе белков.
Получение галогенангидридов и ангидридов
При действии на защищенные по аминогруппе аминокислоты галогенидов фосфора или серы образуются хлорангидриды.
Реакция используется для активации карбоксильной группы при нуклеофильном замещении. Чаще для этой цели получают смешанные ангидриды, которые являются более селективными ацилирующими реагентами.
Реакция используется для активации аминогруппы в синтезе пептидов.
2.4. Специфические реакции аминокислот
Реакции с одновременным участием карбоксильной и аминогрупп идут, как правило, с образованием продуктов, содержащих термодинамически устойчивые 5-ти- и 6-тичленные гетероциклы.
Комплексообразование
a -Аминокислоты образуют прочные хелатные комплексы с ионами переходных металлов (Cu, Ni, Co, Cr и др.).
Отношение аминокислот к нагреванию
Превращения аминокислот при нагревании зависят от взаимного расположения карбоксильной и аминогруппы и определяются возможностью образования термодинамически стабильных 5-ти- 6-тичленных циклов
a -Аминокислоты вступают в реакцию межмолекулярного самоацилирования. При этом образуются циклические амиды – дикетопиперазины.
b -Аминокислоты при нагревании переходят a ,b -непредельные кислоты.
g — и d -Аминокислот претерпевают внутримолекулярное ацилирование с образованием циклических амидов – лактамов
.
Нингидриновая реакция
При взаимодействии a -аминокислот с трикетоном – нингидрином происходит одновременное окислительное дезаминирование и декарбоксилирование с образованием альдегида и окрашенного продукта конденсации.
Реакция используется для количественного анализа аминокислот методом фотометрии.
- a -Аминокислоты, входящие в состав белков
3.1. Строение и классификация
Природные аминокислоты отвечают общей формуле RCH(NH2)COOH и отличаются строением радикала R. Формулы и тривиальные названия важнейших аминокислот приведены в таблице. Для биологического функционирования аминокислот в составе белков определяющим является полярность радикала R. По этому признаку аминокислоты разделяют на следующие основные группы (см. таблицу).
Таблица. Важнейшие
a -аминокислоты RCH(NH2)COOH
| Формула | Название | Обозначение | pI |
| Аминокислоты, содержащие неполярный радикал R | |||
| Глицин | Gly | 5,97 | |
| Аланин | Ala | 6,0 | |
| Валин | Val | 5,96 | |
| Лейцин | Leu | 5,98 | |
| Изолейцин | Ile | 6,02 | |
| Фенилаланин | Phe | 5,48 | |
| Триптофан | Trp | 5,89 | |
| Пролин | Pro | 6,30 | |
| Метионин | Met | 5,74 | |
| Цистин | (Cys)2 | 5,0 | |
| Аминокислоты, содержащие полярный неионогенный радикал R | |||
| Серин | Ser | 5,68 | |
| Треонин | Thr | 5,60 | |
| Гидроксипролин | Hyp | 5,8 | |
| Аспаргин | Asn | 5,41 | |
| Глутамин | Gln | 5,65 | |
| Аминокислоты, содержащие полярный положительно заряженный радикал R | |||
| Лизин | Lys | 9,74 | |
| 5-Гидроксилизин | 9,15 | ||
| Аргинин | Arg | 10,76 | |
| Гистидин | His | 7,59 | |
| Аминокислоты, содержащие полярный отрицательно заряженный радикал R | |||
| Аспаргиновая кислота | Asp | 2,77 | |
| Глутаминовая кислота | Gly | 3,22 | |
| Тирозин | Tyr | 5,66 | |
| Цистеин | Cys | 5,07 | |
Аминокислоты, содержащие неполярный радикал R. Такие группы
располагаются внутри молекулы белка и обуславливают гидрофобные взаимодействия.
Аминокислоты, содержащие полярный неионогенный радикал R.
Аминокислоты этого типа имеют в составе бокового радикала полярные группы, не способные к ионизации в водной среде (спиртовый гидроксил, амидная группа). Такие группы могут располагаться как внутри, так и на поверхности молекулы белка. Они участвуют в образовании водородных связей с другими полярными группами.
Аминокислоты, содержащие радикал R, способный к ионизации в водной среде с образованием положительно или отрицательно заряженных групп.
Такие аминокислоты содержат в боковом радикале дополнительный основный или кислотный центр, который в водном растворе может соответственно присоединять или отдавать протон.
В белках ионогенные группы этих аминокислот располагаются, как правило, на поверхности молекулы и обуславливают электростатические взаимодействия.
3.2. Стереоизомерия.
Все природные a-аминокислоты (кроме глицина) являются хиральными соединениями. По конфигурации хирального центра в положении 2 аминокислоты относят D- или L-ряду.
Природные аминокислоты относятся к L-ряду.
Большинство аминокислот содержат один хиральный центр и имеют два стереоизомера. Аминокислоты изолейцин, треонин, гидроксипролин, 5-гидроксилизин и цистин содержат два хиральных центра и имеют (кроме цистина) 4 стереоизомера, из которых только один встречается в составе белков.
Так, из 4-х стереоизомеров треонина в природе встречается только (2S,3R)-2-амино-3-гидроксибутановая кислота.
Использование для построения белков только одного вида стереоизомеров имеет важное значение для формирования их пространственной структуры и обеспечения биологической активности.
a -Аминокислоты, полученные синтетическим путем, представляют рацемические смеси, которые необходимо разделять. Наиболее предпочтительным является ферментативный способ разделения с помощью ферментов ацилаз, способных гидролизовать N-ацетильные производные только L-a -аминокислот. Ферментативное расщепление проводят по следующей схеме.
Сначала рацемическую аминокислоту ацилируют уксусным ангидридом:
Затем рацемическую смесь ацетильных производных подвергают ферментативной обработке. При этом гидролизуется ацетильное производное только L-аминокислоты:
Полученная после ферментативного смесь легко разделяется, так как свободная L-аминокислота растворяется и в кислотах, и в щелочах, а ацилированная – только в щелочах.
3.3. Кислотно-основные свойства.
По кислотно-основным свойствам аминокислоты разделяют на три группы.
Нейтральные аминокислоты
не содержат в радикале R дополнительных кислотных или основных центров, способных к ионизации в водной среде. В кислой среде они существуют в виде однозарядного катиона и являются двухосновными кислотами по Бренстеду. Как видно на примере аланина, изоэлектрическая точка у нейтральных аминокислот не равна 7, а лежит в интервале 5,5 – 6,3.
pI=1/2(2,34+9,69)=6,01
Основные аминокислоты
содержат в радикале R дополнительный основный центр. К ним относятся лизин, гистидин и аргинин. В кислой среде они существуют в виде дикатиона и являются трехосновными кислотами. Изоэлектрическая точка основных аминокислот, как видно на примере лизина, лежит в области рН выше 7.
pI= 1/2(9,0+10,05)=9,74
Кислые аминокислоты
содержат в радикале R дополнительный кислотный центр. К ним относятся аспаргиновая и глутаминовая кислоты. В кислой среде они существуют в виде катиона и являются трехосновными кислотами. Изоэлектрическая точка этих аминокислот лежит в области рН много ниже 7.
pI= 1/2(2,09+3,86)=2,77
Тирозин и цистеин содержат в боковых радикалах слабые кислотные центры, способные к ионизации при высоких значениях рН.
Важное значение имеет тот факт, что при физиологическом значении рН (~7) ни одна аминокислота не находится в изоэлектрической точке. В организме все аминокислоты ионизированы, что обеспечивает им хорошую растворимость в воде.
Различие в кислотно-основных свойствах используется для разделения аминокислот методом электрофореза и ионообменной хроматографии. При данном значении рН разные аминокислоты могут иметь разный по величине и знаку электрический заряд. Например, при рН6 лизин имеет заряд +1 и движется к катоду, аспаргиновая кислота имеет заряд –1 и перемещается к аноду, а аланин находится в изоэлектрической точке и не перемещается в электрическом поле. Таким образом при рН6 они могут быть разделены с помощью электрофореза.
Для разделения аминокислот методом ионообменной хроматографии используют катионообменные смолы (сульфированный полистирол). Процесс ведут в кислой среде, когда аминокислоты находятся катионной форме.
Скорость продвижения аминокислот по хроматографической колонке зависит от силы их электростатических и гидрофобных взаимодействий со смолой. Наиболее прочно связываются со смолой основные аминокислоты, имеющие наибольший положительный заряд, наименее прочно – кислые аминокислоты. Наибольшим гидрофобным связыванием со смолой обладают аминокислоты с неполярными боковыми радикалами, особенно ароматическими. Таким образом, порядок элюирования аминокислот следующий. Легче других элюируются кислые аминокислоты (Asp и Glu), следом за ними идут аминокислоты, содержащие полярные неионогенные группы (Ser, Thr, Asn, Gln), затем из колонки вымываются аминокислоты с неполярными боковыми радикалами (Phe, Trp, Ile и др.) и в последнюю очередь элюируются основные аминокислоты (His, Lys, Arg).
- 3.4. Реакции аминокислот in vivo
Восстановительное аминирование
– метод синтеза a -аминокислот из a -оксокислот при участии кофермента НАД Н в качестве восстанавливающего реагента.
Трасаминирование
–
основной путь биосинтеза аминокислот. При трансаминировании происходит взаимообмен двух функциональных групп – аминной и карбонильной между аминокислотой и кетокилотой. При этом нужная для организма аминокислота 1 синтезируется из аминокислоты 2, имеющейся в клетках в избыточном коичестве. Реакция осуществляется при участии ферментов трансаминаз и кофермента пиридоксальфосфата.
Содержащий альдегидную группу пиридоксальфосфат служит переносчиком аминогруппы в виде основания Шиффа.
Декарбоксилирование
Аминокислоты декарбоксилируются под действием ферментов декарбоксилаз при участи кофермента пиридоксальфосфата. При этом образуются биогенные амины.
Биогенные амины обладают ярко выраженной биологической активностью. Важнейшими из них являются — коламин (предшественник в синтезе холина и нейромедиатора ацетилхолина), гистамин (обеспечивает аллергические реакции организма), g -аминомасляная кислота (нейромедиатор), адреналин (гормон надпочечников, нейромедиатор)
Дезаминирование
Неокислительное дезаминирование происходит путем отщепления аммиака под действием ферментов с образованием a ,b -непредельных кислот.
Окислительное дезаминирование происходит при участии ферментов оксидаз и кофермента НАД+, который выступает в качестве окислителя. В результате выделяется аммиак и образуется соответствующая кетокислота.
С помощью реакций дезаминирования снижается избыток аминокислот в организме.
4. Пептиды
Петиды – это полиамиды, построенные из a -аминокислот. По числу аминокислотных остатков в молекуле пептида различают дипептиды, трипептиды, тетрапептиды
и т.д. Пептиды, содержащие до 10 аминокислотных остатков, называют
олигопептидами
, более 10 аминокислотных остатков –
полипептидами
. Природные полипептиды, включающие более 100 аминокислотных остатков, называют
белками
.
4.1. Строение пептидов
Формально пептиды можно рассматривать как продукты поликонденсации аминокислот.
Аминокислотные остатки в пептиде связаны амидными (пептидными
) связями. Один конец цепи, на котором находится аминокислота со свободной аминогруппой, называют
N-концом
. Другой конец, на котором находится аминокислота со свободной карбоксильной группой, называют
С-концом
. Пептиды принято записывать и называть, начиная с N-конца.
Название пептида строят на основе тривиальных названий, входящих в его состав аминокислотных остатков, которые перечисляют, начиная с N-конца. При этом в названиях всех аминокислот за исключением С-концевой суффикс “ин” заменяют на суффикс “ил”. Для сокращенного обозначения пептидов используют трехбуквенные обозначения входящих в его состав аминокислот.
Пептид характеризуется аминокислотным составом
и
аминокислотной последовательностью
.
Аминокислотный состав пептида может быть установлен путем полного гидролиза пептида (расщепления до аминокислот) с последующим качественным и количественным анализом образовавшихся аминокислот методом ионобменной хроматографии или ГЖХ-анализом сложных эфиров аминокислот. Полный гидролиз пептидов проводят в кислой среде при кипячении их с 6н. HCl.
Одному и тому же аминокислотному составу отвечает несколько пептидов. Так, из 2-х разных аминокислот может быть построено 2 дипептида, из трех разных аминокислот – 6 трипептидов, из n разных аминокислот n! пептидов одинакового состава. Например, составу Gly:Ala:Val=1:1:1 отвечают следующие 6 трипептидов.
Gly-Ala-Val Gly- Val-Ala Val-Gly-Ala Val-Ala-Gly Ala-Gly-Val Ala-Val-Glu
Таким образом, для полной характеристики пептида необходимо знать его аминокислотный состав и аминокислотную последовательность.
4.2. Определение аминокислотной последовательности
Для определения аминокислотной последовательности используют комбинацию двух методов: определение концевых аминокислот и частичный гидролиз.
Определение N-концевых аминокислот.
Метод Сегнера. Пептид обрабатывают 2,4-динитрофтробензолом (ДНФБ), а затем полностью гидролизуют. Из гидролизата выделяют и идентифицируют ДНФ-производное N-концевой аминокислоты.
Метод Эдмана состоит во взаимодействии N-концевой аминокислоты с фенилизотиоцианатом в щелочной среде. При дальнейшей обработке слабой кислотой без нагревания происходит отщепление от цепи “меченой” концевой аминокислоты в виде фенилгидантоинового (ФТГ) производного.
Преимущество этого метода состоит в том, что при отщеплении N-концевой аминокислоты пептид не разрушается и операцию по отщеплению можно повторять. Метод Эдмана используют в автоматическом приборе – секвенаторе, с помощью которого можно осуществить 40 – 50 стадий отщепления, идентифицируя полученные на каждой стадии ФТГ-производные методом газожидкостной хроматографии.
Частичный гидролиз полипептидов
При частичном гидролизе пептиды расщепляются с образованием более коротких цепей. Частичный гидролиз проводят с помощью ферментов, которые гидролизуют пептидные связи избирательно, например, только с N-конца (аминопептидазы
) или только с С-конца (
карбоксипептидазы
). Существуют ферменты, расщепляющие пептидные связи только между определенными аминокислотами. Меняя условия гидролиза, можно разбить пептид на различные фрагменты, которые перекрываются по составляющим их аминокислотным остаткам. Анализ продуктов частичного гидролиза позволяет воссоздать структуру исходного пептида. Рассмотрим простейший пример установления структуры трипептида. Частичный гидролиз по двум разным направлениям трипептида неизвестного строения дает продукты представленные на схеме.
Единственный трипептид, структура которого не противоречит продуктам частичного гидролиза – Gly-Ala-Phe.
Установление аминокислотной последовательности пептидов, содержащих несколько десятков аминокислотных остатков, – более сложная задача, которая требует комбинации различных методов.
4.3. Синтез петидов
Синтез пептида с заданной аминокислотной последовательностью – чрезвычайно сложная задача. В простейшем случае синтеза дипептида из 2-х разных аминокислот возможно образование 4-х разных продуктов.
В настоящее время разработана стратегия синтеза пептидов, основанная на использовании методов активации
и
защиты
функциональных групп на соответствующих этапах синтеза. Процесс синтеза дипептида включает следующие стадии:
- защита аминогруппы N-концевой аминокислоты;
- активация карбоксильной группы N-концевой аминокислоты;
- конденсация модифицированных аминокислот
- снятие защитных групп
Таким образом, последовательно присоединяя аминокислоты, шаг за шагом наращивают цепь полипептида. Такой синтез очень длителен, трудоемок и дает низкий выход конечного продукта. Основные потери связаны с необходимостью выделения и очистки продуктов на каждой стадии.
Этих недостатков лишен используемый в настоящее время твердофазный синтез пептидов
. На первой стадии защищенная по аминогруппе С-концевая аминокислота закрепляется на твердом полимерном носителе (полистироле, модифицированном введением групп –CH2Cl). После снятия защиты проводят ацилирование аминогруппы закрепленной на носителе аминокислоты другой аминокислотой, которая содержит активированную карбоксильную и защищенную аминогруппу. После снятия защиты проводят следующую стадию ацилирования. Отмывание продукта от примесей проводят прямо на носителе и лишь после окончания синтеза полипептид снимают с носителя действием бромистоводородной кислоты. Твердофазный синтез автоматизирован и проводится с помощью приборов – автоматических синтезаторов.
;
Методом твердофазного синтеза получено большое количество пептидов, содержащих 50 и более аминокислотных остатков, в том числе инсулин (51 аминокислотный остаток) и рибонуклеаза (124 аминокислотных остатка).